疾病详情
定义胰腺癌(pancreatic carcinoma)(图1)是消化系统恶性程度较高的肿瘤。2000年至2013年,胰腺癌的发病率和死亡率呈逐年上升的趋势。2013年预计美国人胰腺癌的新发病例数将达到45 220例,新发死亡病例数将达到38460例。据全国肿瘤登记中心汇总并分析的2009年全国72个地区的发病及死亡情况显示:我国胰腺癌在全身恶性肿瘤中发病率已上升到第7位,死亡率居恶性肿瘤第6位。发病率在男性为7.28/10万,死亡率达6.61/10万。男性高于女性,城市地区(7.42/10万)高于农村地区(5.41/10万)。胰腺癌恶性程度高、不易早期发现、转移早而快、预后差,传统外科、化疗以及放疗的治疗效果均不理想。

图1
肿瘤的分子生物学基础 与大多数肿瘤一样,胰腺肿瘤也是基因相关性疾病。胰腺导管腺癌是最为常见的胰腺肿瘤,也是其中分子机制最为明确的肿瘤。一方面的证据显示,尽管在肿瘤发生的过程中,基因突变是随机的,但是积累的主要基因改变基本相同,因此存在一个选择的过程。胰腺导管腺癌通常有特定的遗传学改变,其中包括相当特殊的一群基因改变,发生频率较高的有KRAS2(>90%)、CDKN2A/p16/MTS1(95%)、TP53(50%~75%)以及MADH4/SMAD4/DPC4(55%)。KRAS2基因的突变先于其他基因改变。发生频率相对较低的基因改变有BRCA2 MKK4、STK11等。此外,还存在特定表遗传的改变以及一些生长因子相关基因,如HER2/ NEU/ERBB2,EGF及其受体EGFR,FGF及其受体FGFR,IGF-I及其受体以及VEGF等的过度表达。另一方面的证据来自于研究中发现具有某些特定基因改变的人群具有更高发生胰腺癌的倾向,遗传易感性的患者占5%~10%,在家族性胰腺癌的研究中更能反映这一点,如CDKN2A基因突变、BRCA-2突变的家族。研究胰腺癌的分子生物学背景,是认识胰腺癌发生发展、诊断、分类以及治疗的理论基础。
流行病学 胰腺癌的发病,男性高于女性,40岁以下少见,随着年龄增加,胰腺癌的发病率逐渐提高,80%以上的患者在60~80岁的年龄组内。西方国家发病率较高,日本与西方国家相近,科威特、印度、新加坡和我国的发病率较低。在人种方面,美国白人和黑人的发病率都较高,但黑人的发病率要明显高于白人。Hassan等进行的一项大样本病例对照研究选取了808例胰腺癌患者和808例健康人作为对照,对胰腺癌的高危因素进行了研究,结果显示吸烟、胰腺癌家族史、酗酒(>60ml/d)、糖尿病和胰腺炎病史都是胰腺癌明确的高危因素。具有前四项高危因素的胰腺癌患者占全部病例的比例分别为23%、5%、3%和9%。同时发现在这些高危因素之间存在协同效应。大量前瞻性研究及病例对照研究表明,戒烟,提倡低脂肪、低红肉类的食谱,避免肥胖,减少酗酒,减少职业暴露(如β苯胺类和对二氨基联苯等化学物),改变人们的生活方式和不健康的行为可能是降低胰腺癌发病和死亡率的有效措施。
病理 90%为来自导管上皮细胞发生的导管腺癌,其他少见类型的胰腺癌包括未分化癌、胶样癌、髓样癌、鳞癌及腺泡细胞癌等。胰腺癌中的2/3好发于胰头和钩突部,其余位于体、尾部。胰腺癌浸润性强,并通过胰内淋巴管扩散至胰腺内的胆总管下端、神经组织、静脉、淋巴结和邻近器官。患者就诊时多有相关淋巴结转移以及邻近脏器侵犯或已发生远处转移。胰腺癌累及的相关淋巴结多见于胰头后、肠系膜根部、胰头前部、脾动脉干以及腹腔动脉周围淋巴结。胰腺癌可直接浸润十二指肠、胃、脾、肾上腺及横结肠等脏器。部分患者可血行转移至肝、肺、骨等。
临床病理分期 临床病理分期是选择胰腺癌合理治疗方案的基础。国际抗癌联盟(UICC)和美国肿瘤联合委员会(AJCC)于2009年公布了第7版TNM分期系统,去除了第6版远处转移的Mx,目前已得到广泛的认可,详细内容如表1所示。
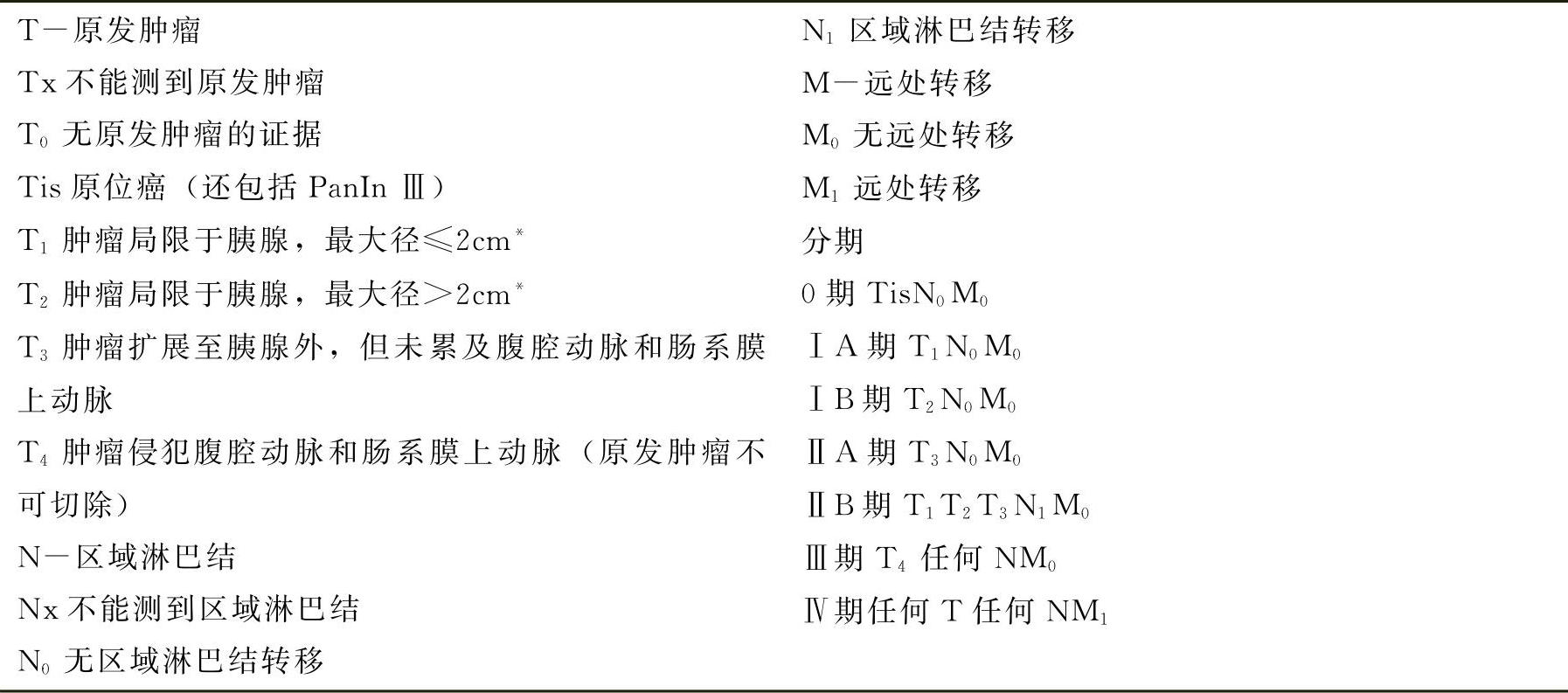
表1 UICC/AJCC TNM分期系统
临床表现 绝大多数的胰腺癌为起源于胰腺导管上皮细胞的腺癌,在早期没有任何自觉症状,只有在肿瘤发展增大到一定程度时才开始出现症状,而且首先出现的临床症状通常无特异性,易与上腹部的其他脏器的疾病(如胃十二指肠、肝胆等器官的疾病)相混淆。在胰腺癌的首发症状中,以上腹部疼痛和(或)上腹部饱胀不适、黄疸、食欲缺乏和消瘦为最多见。
1.腹痛 大部分患者都有程度不一的腹痛。由于癌变的部位和引起疼痛的机制不一,腹痛可表现多样。在病变早期主要为中上腹部不易定位、性质较模糊的隐痛、钝痛或饱胀不适早期腹痛是由于肿瘤压迫、侵犯胰管,导致胰管梗阻,压力增高。胰头肿瘤压迫侵犯胆道时,由于胆囊增大,肝包膜被牵张,可有右上腹痛。胰体尾癌可为左侧上腹痛。当病变侵犯腹膜时,可引起较明显的上腹痛。进展期病变常有腰背痛,多由于腹腔神经受浸润所致,典型的腰背痛剧烈、持续不缓解,表现为夜间仰卧时加重,使患者辗转难眠,不能平卧。
2.食欲缺乏和消瘦 多于75%的患者有明显的体重减轻,可能是由于胰液、胆汁分泌不足导致食欲缺乏、消化吸收不良及消耗过多。部分患者在病程早期可仅表现为不明原因的进行性消瘦,尤其病变在胰体尾部的患者。一般体重平均减轻10kg左右,体重减轻越多、越快,癌肿切除的可能性越小。
3.黄疸 进行性黄疸是胰头癌的首发症状之一。钩突部癌患者出现黄疸稍晚,而胰体尾癌则在病程晚期,肝内有转移或肝门、肝十二指肠韧带淋巴结转移压迫胆管时才出现黄疸。肝脏和胆囊因胆汁淤滞而肿大,肿大的胆囊有时被肿大的肝所遮盖,不易触及。黄疸呈进行性,随黄疸加重,粪便呈白陶土色,尿液颜色越来越深,多数患者同时伴有皮肤瘙痒。
4.其他 少数患者在病程中因胆道感染出现持续性低热,甚至出现寒战、高热。少数胰腺癌患者可有典型的急性或亚急性胰腺炎发作。胰腺癌与糖尿病的关系十分复杂,老年新发的糖尿病,缺乏家族史,无肥胖,有体重减轻症状,很快形成胰岛素抵抗者要十分警惕。当肿瘤压迫门静脉、门静脉血栓形成以及肿瘤浸润腹膜时可出现腹水、低蛋白血症。肿瘤压迫脾动脉和腹主动脉时可在上腹部听到血管杂音。当侵犯胃、十二指肠时可以出现恶心、呕吐,甚至呕血、黑便。
诊断 1.实验室检查
(1)血清生化检查:常用的生化检查,如血清胆红素和酶类(碱性磷酸酶等)只有在胆道梗阻时才见升高。黄疸患者的血清胆红素常超过256.5μmol/L(15mg/dl),常高于胆石症慢性胰腺炎所致的胆道梗阻,但缺乏特异性,不适用于胰腺癌的早期诊断。在病情早期可出现血、尿淀粉酶升高,空腹血糖升高,糖耐量异常。
(2)肿瘤标志物:胰腺癌标志物文献中已报告20余种,主要检测指标包括CA19-9、抗黏蛋白抗体CAM17.1、癌胚抗原(CEA)、胰胎瘤抗原(POA)、胰腺癌相关抗原(PCAA) CA50、CA125、CA195、CA242、Span-1、Dupan-2等。目前对肿瘤标志物的诊断价值评价是特异性不强,存在假阳性,早期胰腺癌阳性率低,CA19-9是特异性和敏感性相对较高的一种。
CA19-9即糖抗原决定簇19-9(carbohydrate antigenic determinant 19-9),CA19-9是目前对胰腺癌诊断最具价值的标志物之一。其血清临界值为37U/ml。CA19-9的血清含量与肿瘤大小及是否有扩散有一定相关关系。低水平者(<200U/ml)的手术切除率大,高水平者(>600U/ml)几乎无法切除。梗阻性黄疸也可引起CA19-9明显增高,因此梗阻解除,减黄治疗之后的血清CA19-9含量更具临床意义。大肿瘤切除后CA19-9明显降至正常者预后较好。其他各种腺癌如胃癌、结肠癌患者的血清中也可检出CA19-9,但含量不一。CA19-9对于胰腺癌与慢性胰腺炎的鉴别也有一定帮助,而其在胰腺癌普查筛选及早期诊断方面的应用价值仍有限。
2.影像学检查 影像学诊断近来有较大进展,如螺旋CT、磁共振成像、正电子放射断层扫描、腔内超声、内镜逆行胰胆管造影、腹腔镜等新技术的应用,使诊断及术前对肿瘤可切除性的判断有了提高。其中腔内超声,如内镜超声检查术、内镜超声引导下的细针穿刺术、胰管内超声的出现,大大提高了胰腺肿瘤的早期诊断正确率。该领域的新成员———三维腔内超声彩色多普勒腔内超声也有广阔的应用前景。
(1)B超扫描:B超检查具有无创性、费用低等优点,是常规影像学检查方法,可提示肝内外胆管有无扩张、肝外胆管梗阻的部位、胰头或胆总管下端有无肿块。正常胰头部前后径不超过3cm,胰体尾部不超过2cm,若发现腺体增大、外形不规则,伴有胰管及肝内外胆管扩张应怀疑患有胰腺肿瘤。但是超声对诊断<2cm的肿瘤有一定困难。
(2)CT扫描:近年来随着螺旋快速CT、薄层CT、胰腺及血管重建技术的发展结合动态增强技术,使发现直径为1cm小肿瘤的准确性越来越高。CT检查能较清晰地显示胰腺的形态、肿瘤的位置以及肿瘤与邻近血管、器官的关系,是具有高度可靠性的检查方法。胰腺癌在CT扫描时主要表现为局部肿块、胰腺外形轮廓异常增大、肿瘤坏死所致的局灶性密度减低胰腺周围脂肪层消失、胰管扩张、邻近血管的侵犯及后腹膜淋巴结、肝内转移等(图2)根据CT图像可以判断切除的可能性。2013年美国国立综合癌症网络(NCCN)指南提出:肿瘤局限,可以完全切除的标准为:①无远处转移;②没有肠系膜上静脉及门静脉受侵犯的影像学证据;③腹腔干、肝动脉、肠系膜上动脉周围有明确的脂肪间隙。可能切除(borderline re-sectable)的标准为:①无远处转移;②静脉包括肠系膜上静脉和门静脉受侵犯或狭窄的程度能满足近远端在切除后能安全吻合或置换的要求;③胃十二指肠动脉被包裹延伸至肝动脉但没有累及腹腔干;④肿瘤累及肠系膜上动脉并没有超过血管壁周径的180°。
(3)磁共振成像(MRI):发现征象与CT相似。近年来,由于快速扫描、口服顺磁性对比剂和磁共振胆管成像等技术的应用,MRI成为胰腺癌较为有效的诊断方法之一,其中,磁共振胆管成像(MRCP)无创伤、无需造影剂,可了解梗阻的部位及病变的范围,同时可了解肿瘤与毗邻器官和血管的关系,有较强的应用价值。

图2 增强CT显示的胰头癌
(4)正电子发射计算机断层显像(positron emission computed tomography,PET):其原理是将人体代谢所必需的物质制成显像剂注入人体后进行扫描成像,因为绝大部分恶性肿瘤葡萄糖代谢高,显像剂注入后会在恶性肿瘤细胞内积聚起来,所以PET能够鉴别恶性肿瘤与良性肿瘤及正常组织,其诊断准确率在90%以上,灵敏度高。对肿瘤诊断的分期,治疗方案的选择起到重要的指导作用。
(5)内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP): ERCP可以通过直接观察、造影诊断肿瘤。胰腺癌时主胰管造影的表现可为狭窄、管壁僵硬扩张、中断、移位、不显影或造影剂排空延迟等。有时ERCP的胰管造影表现与慢性胰腺炎难以鉴别。经内镜收集胰液进行细胞学、生化和酶学检查,可以提高肿瘤检出率。另外,对于深度黄疸或伴有感染的患者,可以经内镜放置胆道内支架鼻胆管引流,对于某些胰腺导管内乳头状黏液瘤,IPMN及十二指肠憩室炎可起到确诊的作用。
(6)内镜超声检查术(endoscopic ultrasonography,EUS):EUS能显示胰实质或胰管系统内5mm大小的肿块,敏感性很高,且能显示淋巴转移。对疑有胰腺癌的患者,内镜超声引导细针抽吸活检(EUS-guided fine-needle aspiration,EUS-FNA)是一种安全、有效的诊断手段,可为疑有胰腺癌患者提供组织学诊断和评估。其敏感性、特异性均很高。
(7)经皮肝胆管穿刺造影引流术(percutaneous transhepatic cholangiography drainage, PTCD):对有阻塞性黄疸、肝内胆管扩张的患者,行ERCP有困难时可行PTCD,以显示肝内外胆管扩张的程度、狭窄中断的部位等,并可引流胆汁,达到减黄目的。与ERCP相比, PTCD保留了十二指肠乳头完整性,减少了因胆汁反流出现的发热、胆管炎等并发症。但容易出现胆汁漏、出血等并发症。
(8)选择性血管造影:选择性肠系膜上动脉、腹腔动脉造影,可以判断胰腺肿瘤的部位大小、浸润范围,是否累及血管,肝内有无转移灶等征象,从而确定手术切除的可能性和手术方式。选择性血管造影对诊断<2cm的肿瘤有较高的准确性,但属有创性检查,需严格把握指征。鉴别诊断应与胰腺周围的恶性肿瘤,如壶腹癌、胆总管下段癌、十二指肠癌、转移癌等相鉴别。也应与慢性胰腺炎、胆总管下段结石、硬化性胆管炎、十二指肠憩室炎等良性疾病相鉴别。随着螺旋CT的快速发展,血管三维重建技术在临床广泛应用,选择性血管造影目前已很少使用。
治疗胰腺癌患者的传统外科、化疗以及放疗的治疗效果均不理想。总的5年生存率低于4%,只有很少数肿瘤直径小于2cm、局限在体尾部以及没有淋巴结转移的患者根治术后5年生存率可达18%~24%,进展期的患者5年生存率小于1%并多于1年内死亡。治疗前需要通过各类检查确定患者的病情,主要是通过影像学检查,甚至可以采用有创的腹腔镜结合超声进行检查,对肿瘤进行TNM分级与分期,以确定肿瘤的治疗方案,减少不必要的盲目探查。
治疗方案的选择:经过多学科(胰腺外科、影像科、病理科、消化内科、肿瘤科、放疗科、核医学科、超声诊断科)会诊,对于无远处转移的胰腺癌患者如能够耐受手术、估计肿块可切除的胰头癌均可以施行根治性Whipple手术。体尾部肿瘤行远端胰腺切除,或切缘不足时采用全胰切除,争取R0切除(影像学判断标准见辅助检查部分)。根治性手术后可以加用化疗以及放疗。对于不能切除的患者应给予化疗以及放疗,并采取姑息治疗,如姑息性胆肠吻合胃肠捷径手术、介入胆道内支架或内镜下胆道支架罩入。疼痛可采用放射治疗,也可同时给予化疗,术中探查时注射50%无水乙醇以阻滞内脏神经能有效缓解疼痛。对于不能切除的患者以及术后复发的患者除了上述的姑息治疗措施外,应该给予积极的支持治疗和止痛治疗。
1.手术治疗 手术是治疗胰腺癌的主要手段,但由于胰腺癌早期诊断率很低,所以胰腺癌根治性手术切除率较低,文献报道差别较大,平均20%~30%。胰腺癌根治手术后局部复发是影响胰腺癌预后的重要原因,因此要保证手术切缘阴性,尽量做到R0切除;R1切除术后的生存获益可能与不行手术仅行放化疗的患者相当。近年提倡“整块切除”的概念,即完整切除肠系膜上动脉右侧的淋巴结、神经、结缔组织等,包括腹膜后组织在内,而不仅仅是在钩突部切断胰腺。标准手术方案为胰十二指肠切除术(Whipple手术),适用于可手术切除的胰头癌,切除范围包括胰头、远端胃、十二指肠全部、下段胆管、上段空肠和胆囊,然后进行复杂的消化道重建(图3),胰头癌淋巴结转移主要集中在肝、十二指肠韧带内,腹腔动脉及其分支周围,胰头前后方上下,肠系膜上动脉周围以及腹主动脉周围等淋巴结。因此,标准的胰十二肠切除术包括十二指肠和胰腺,肝十二指肠韧带的右侧,肠系膜上动脉的右侧,胰十二指肠前方和后方的淋巴结。扩大的淋巴结清扫还包括清除从右侧的肾门到腹主动脉左侧的后腹膜软组织,以及左侧的从门静脉到肠系膜下动脉之间的软组织。然而,对有学者主张应适当扩大清除淋巴结的论点仍存有争议。最近,来自意大利、美国和日本的前瞻性临床研究结果表明,与标准的淋巴结清扫术相比,腹膜后淋巴结扩大清扫术并不能延长胰腺癌患者的生存时间。因此,目前认为,淋巴结扩大清除没有提高早期患者的长期存活率,且患者术后生活质量很差。
2013年NCCN指南建议:扩大淋巴结清扫不应该是胰十二肠切除术的常规,除对腹主动脉、下腔静脉及肝总动脉周围的淋巴结进行清扫或取样,这些部位的淋巴结阳性预示着预后较差。
胰体尾切除术适用于胰体尾的肿瘤。扩大切除术(联合脏器切除术)适用于肿瘤侵及周围脏器和血管,在标准手术方案基础上做多个脏器和血管切除,术后行消化道重建、血管重建,手术风险大,患者生存率没有明显提高,应谨慎选用。由于发现胰腺癌有16%~37%呈多中心癌灶,手术切缘常存留癌组织,因此有人采用全胰切除术或次全胰切除术,该手术有利于清扫区域淋巴结,但手术创伤大,可有严重的机体代谢紊乱,术后需补充胰岛素及消化酶。对于保留幽门的问题,数个随机及非随机研究证实,保留幽门的胰十二指肠切除术缩短了手术时间。然而,没有一致的数据表明其能改善患者术后的生活质量及营养状况。但其仍为临床的一种选择。
对于肿瘤已无法切除或患者体质和重要脏器功能不能耐受根治性手术,同时伴有胆道、消化道梗阻的,应行姑息手术,如胆肠吻合、胃肠捷径手术等。对于肿瘤侵犯腹腔神经丛,导致难以忍受剧痛的患者,可术中用50%的无水乙醇行腹腔神经丛阻滞术。亦可用皮下埋置止痛泵经硬膜外管给予止痛药或麻醉药阻滞神经根止痛。术中可行放疗或埋置金属标记用以术后放疗。
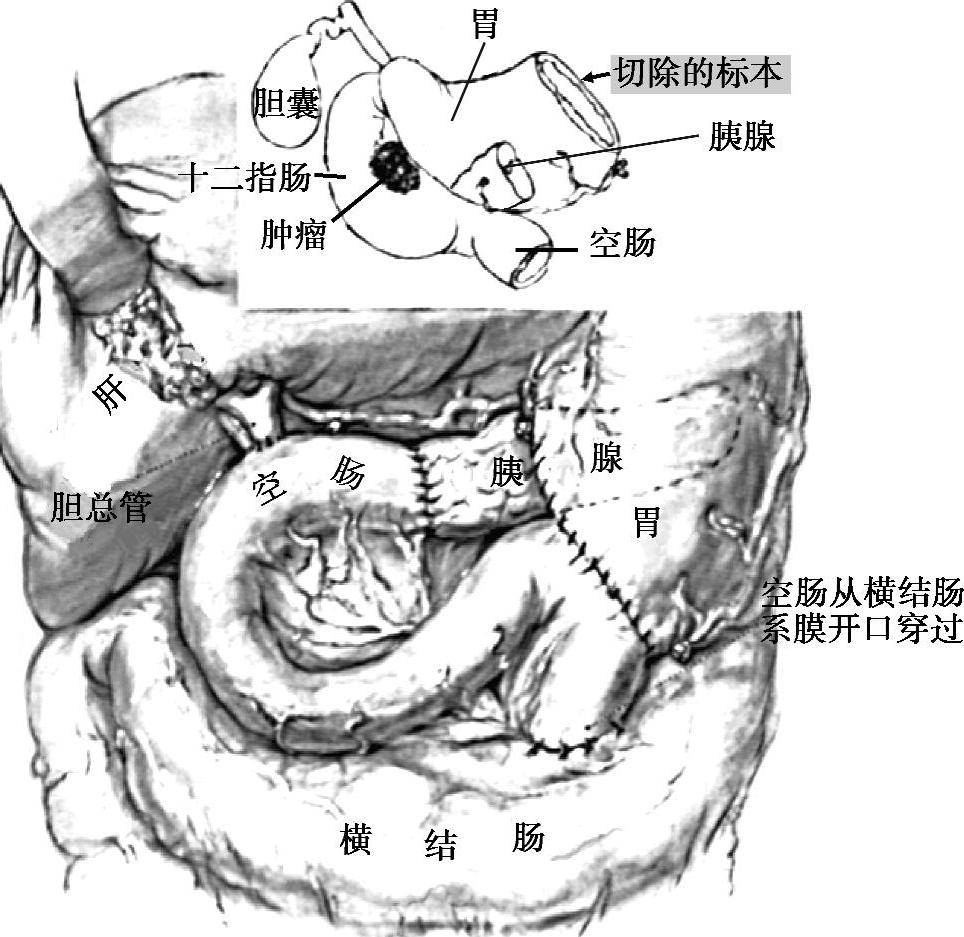
图3 标准胰十二指肠切除范围与消化道重建(Whipple手术)
2.其他治疗 胰腺癌的手术切除率和术后5年生存率均低,就诊患者多出现全身播散因此,药物治疗是治疗胰腺癌不可缺少的部分。目前有许多临床试验正在进行治疗方案以及新药物的研究,术前放化疗、术中放化疗、放疗增敏剂、新的化疗方案、新的化疗药物的治疗效果是目前临床研究的重点。胰腺癌的化疗方案众多,但也反映出尚缺乏明显有效的化疗方法目前国际及国内均已将吉西他滨作为胰腺癌化疗的一线用药,它是一种脱氧胞嘧啶核苷类似物,其结构与阿糖胞苷相似,是细胞周期特异性抗代谢类药物,常与基于氟尿嘧啶的放、化疗联合或序贯使用。NCCN的专家组认为,单独化疗时,吉西他滨由于毒性较低而优于氟尿嘧啶和亚叶酸钙。卡培他滨被列为2B类,在其他方案不可选或不可接受时,作为最后的治疗选择
放射治疗对部分病例能起到缓解症状的作用,少数患者的病情可得到暂时控制,生存期延长,也适用于胰腺癌术前及术后的辅助治疗。出现胆道梗阻时,用介入放射学或内镜技术,放置引流管或金属支架行胆汁引流,缓解黄疸,改善由于梗阻性黄疸引起的各种症状,提高生活质量。
处置建议
病情评估/分型 胰腺癌主要指胰外分泌腺腺癌,是胰腺恶性肿瘤中最常见的一种。胰腺癌早期症状隐匿,出现典型症状时多属晚期,恶性恶性程度高,进展迅速。按病变部位分胰头癌(占60%~70%)、胰体尾部癌(占25%~30%)、全胰癌(占5%)。90%胰腺癌起源于导管上皮细胞称导管细胞癌,少数来源于胰腺的小胰管上皮细胞。来自胰管的胰腺癌质地坚硬称硬癌,起源于胰腺泡细胞的胰腺癌称胰泡细胞癌(肉质型)。其他少见的有:黏液性囊腺癌、胰母细胞瘤、黏液性非囊性癌(胶样癌)、印戒细胞癌、腺鳞癌、巨细胞癌、肉瘤样癌以及神经内分泌癌、平滑肌肉瘤、脂肪肉瘤、浆细胞瘤、淋巴瘤等非上皮来源恶性肿瘤。(胰管开口处的)壶腹部癌以腺癌多见,黄疸症状出现早,黄疸深,持续进行性加重。胰头癌黄疸进行性加重,可有波动。评估胰腺癌是否可切除,是否联合血管切除(安全性评价)以及是否可做到R0切除(有效性评价)
转诊/住院 通常胰腺癌病情进展迅速建议转诊至较大规模的诊疗中心并在多学科综合治疗团队(MDT)的模式下进行,包括外科、影像、内镜、病理、肿瘤内科、介入、放疗等专业人员的参与,并贯穿诊治的全过程
治疗原则 根据病人的基础健康状况、临床症状、肿瘤分期及病理类型,个体化地采取多学科综合治疗策略以达到最佳的治疗效果。胰腺癌的治疗包括外科手术、化学治疗、放射治疗、介入治疗等。手术治疗是唯一能治愈胰腺癌的方法,只要有条件力争根治性切除。对可切除的胰腺癌,大多数胰头癌为R1切除,R0切除作为提倡的手术目标,R2切除与短路手术相比无助于改善患者预后,不建议行姑息性胰十二指肠切除术,应力求避免R2切除。姑息治疗目的为缓解胆道及消化道梗阻,提高生活质量,延长生命。约2/3的胰腺癌病人合并黄疸,对于不可切除、合并梗阻性黄疸的胰腺癌病人,首选内镜下经十二指肠乳头胆道内置入支架(金属支架或塑料支架)缓解黄疸。合并十二指肠梗阻无法内镜置入支架的病人,可经皮肝穿刺置管外引流,亦可将引流管经乳头置入十二指肠内,内外引流,亦可尝试支架置入十二指肠缓解消化道梗阻
三阶段疗 推荐采用“三阶段疗法”治疗大胰头癌,减黄、介入治疗、手术切除。减黄可改善肝功能;介入治疗可减轻门静脉、肠系膜上血管的受侵程度,使肿瘤缩小或界线相对清楚,为手术创造条件;手术则采用合理性的区域性胰十二指肠切除
手术治疗 不同疾病阶段手术目的不同。对早期胰腺癌手术是唯一根治手段;对局部晚期胰腺癌手术是综合治疗的一部分;对晚期胰腺癌手术可能是支持治疗的一部分。切除范围主要指周围器官或血管。胰十二指肠切除、胰体尾切除及全胰腺切除三种术式。标准术式亦包括胰腺以外的其他脏器切除故不再使用“联合脏器切除”的称谓。切缘判断标准:R0切除、R1切除、R2切除。以“1mm”原则为判断标准,距切缘大于1mm以上无肿瘤细胞者为R0切除(镜下切缘阴性),否则为R1切除,镜下切缘阳性)。目前姑息性切除特指R2切除(肉眼切缘阳性)
在淋巴结清扫范围问题上推荐使用标准范围的淋巴结清扫。扩大淋巴结清扫对患者预后影响研究尚不完全
温馨提示 治疗前需有病理诊断的几种情况
1. 对于可能切除的胰腺癌拟行新辅助治疗的患者,必须有明确的病理学诊断结果
2. 不可切除的胰腺癌拟行化放疗的患者,必须有病理学诊断结果的支持
3. 开腹探查发现肿瘤不可切除,拟行姑息短路治疗的患者,术中应获取病理学诊断结果,以指导后续辅助治疗
胰十二指肠切除标本的标准化检测:由外科及病理科医师合作完成,对标本的下述切缘分别进行标记及描述,以客观准确地反映出切缘状态。胰腺前侧(腹侧)切缘;胰腺后侧(背侧)切缘;胰腺肠系膜上静脉沟槽切缘;胰腺肠系膜上动脉切缘;胰腺断端;胆管切缘;空肠切缘。对联合肠系膜上静脉或门静脉切除,应对静脉受累状况分别取材报告,并据浸润深度做下述分类:静脉壁外膜受累;累及静脉壁,但内膜未受累;累及静脉壁全层
用药建议
辅助化疗药物 吉西他滨、紫杉醇(白蛋白结合型)、5-氟尿嘧啶、奥沙利铂、伊立替康、亚叶酸(LV)、S-1(口服氟尿嘧啶类药物)S-1疗效优于传统5-FU,S-1单药效果优于吉西他滨单药效果
靶向治疗药物 西妥昔单抗、贝伐珠单抗、厄洛替尼
化疗方案推荐 可切除胰腺癌术后辅助化疗的首选标准方案:吉西他滨单药与S-1单药
晚期胰腺癌的一线化疗方案:吉西他滨+紫杉醇(白蛋白结合型)、FOLFIRINOX方案(奥沙利铂+伊立替康+LV+5-FU)、吉西他滨单药、GS方案(吉西他滨+S-1)、S-1单药、吉西他滨+厄洛替尼
检查建议
胰腺CT 是疑有胰腺肿瘤病人的首选影像学检查。针对胰腺肿瘤应设置特别扫描参数,对全腹部行对比剂加强扫描,包括薄层(<3mm)、平扫、动脉期、实质期、门静脉期及三维重建等,以准确描述肿瘤大小、部位及有无淋巴结转移特别是与周围血管的结构关系
腹部超声 作为筛查手段,对梗阻部位及病变性质等做初步评估。受胃肠道气体的干扰和操作者技术及经验水平的影响诊断价值有限
肿瘤标记物 血清CA19-9的上升水平有助于胰腺癌与其他良性疾病的鉴别。CA19-9诊断胰腺癌的敏感性为79%~81%,特异性为82%~90%。CA19-9水平的监测也是判断术后肿瘤复发、评估放化疗效果的重要手段。约3%~7%的胰腺癌病人为Lewis抗原阴性血型结构,不表达CA19-9,故此类胰腺癌病人检测不到CA19-9水平的异常。胆道梗阻及胆管炎亦可导致CA19-9升高。在黄疸缓解后检测CA19-9更有意义。其他肿瘤标记物包括CEA、CA50、CA242等,联合应用有助于提高诊断敏感性及特异性
胰腺MRI 与CT同等重要,在排除及检测肝转移病灶方面,敏感性及特异性优于CT
PET/CT 作为补充,在排除及检测远处转移方面具有优势。推荐应用于原发病灶较大、疑有区域淋巴结转移及CA19-9显著升高的病人。但其不可替代胰腺CT或MRI
内镜超声 可准确描述病灶有无累及周围血管及淋巴结转移,在诊断门静脉或肠系膜上静脉是否受累方面,敏感性及特异性优于肠系膜上动脉的检测
腹腔镜探查 不建议常规应用,对于瘤体较大、疑有腹腔种植或远处转移的病人,可行腹腔镜探查以避免不必要的开腹探查
病理学诊断 对于影像学诊断明确,具有手术指征的病人,行切除术前无需病理学诊断,亦不应因等待病理学诊断而延误手术。对拟行新辅助治疗或病灶不可切除拟行放化疗的病人,治疗前须明确病理诊断
获取组织或细胞行病理学诊断的途径包括超声或CT引导下经皮穿刺活检、ERCP胰液细胞刷取、EUS引导细针穿刺活检(EUS-FNA)等。首选EUS途径获取组织标本。对于影像学表现典型而EUS-FNA活检阴性的病人,应再行EUS-FNA活检
对于术中探查为不可切除拟行姑息治疗的病人,须获取组织标本进行病理学诊断,以指导后续放化疗,可切割针直接穿刺或经十二指肠穿刺活检,操作中避免引发胰瘘
患者指导
危险因素控制 胰腺癌危险因素包括吸烟、肥胖、酗酒、慢性胰腺炎等,接触萘胺及苯类化合物者罹患胰腺癌的风险显著增加。糖尿病是胰腺癌的风险因素之一,特别是老年、低体重指数、无糖尿病家族史的病人,新发2型糖尿病时应注意随访并警惕胰腺癌的可能。胰腺癌具有遗传易感性,约10%的胰腺癌病人具有遗传背景。遗传性胰腺炎、Peutz-Jeghers综合征、家族性恶性黑色素瘤及其他遗传性肿瘤疾患的病人,胰腺癌的风险显著增加
预防 胰腺癌主要症状包括上腹部不适、体重减轻、恶心、黄疸、脂肪泻及疼痛等,均无特异性。对怀疑胰腺癌和胰腺癌的高危人群,应首选无创性检查手段进行筛查,如血清学肿瘤标记物、超声、胰腺CT或MRI等
随访 胰腺癌术后病人随访,术后2年内应每3~6个月随诊1次,实验室检查包括肿瘤标记物、血常规及生化等,影像学检查包括超声、X线及腹部CT等
预后 胰腺癌预后差,发现时多属于中晚期,胰腺癌位列我国男性恶性肿瘤发病率的第8位,死亡率的第7位,且在全球范围内呈快速上升趋势
诊断依据
诊断依据 主要症状
上腹疼痛不适、食欲不振、腹胀、消化不良、恶心、呕吐、腹泻或便秘等消化道症状;消瘦、乏力、体重下降,晚期可以出现恶病质
体征
进行性加重的黄疸、肝大、胆囊肿大,晚期患者可以扪及上腹部肿块
影像学检查
B超或内镜超声;胰腺薄扫三期CT及三维重建;MRI或MRCP;ERCP
实验室检查
伴有梗阻性黄疸时会出现血清总胆红素和直接胆红素升高,碱性磷酸酶和转氨酶升高;CA19-9、CEA、CA242等血清学肿瘤标记物可能会增高








