帮您快速找医生
-
内科
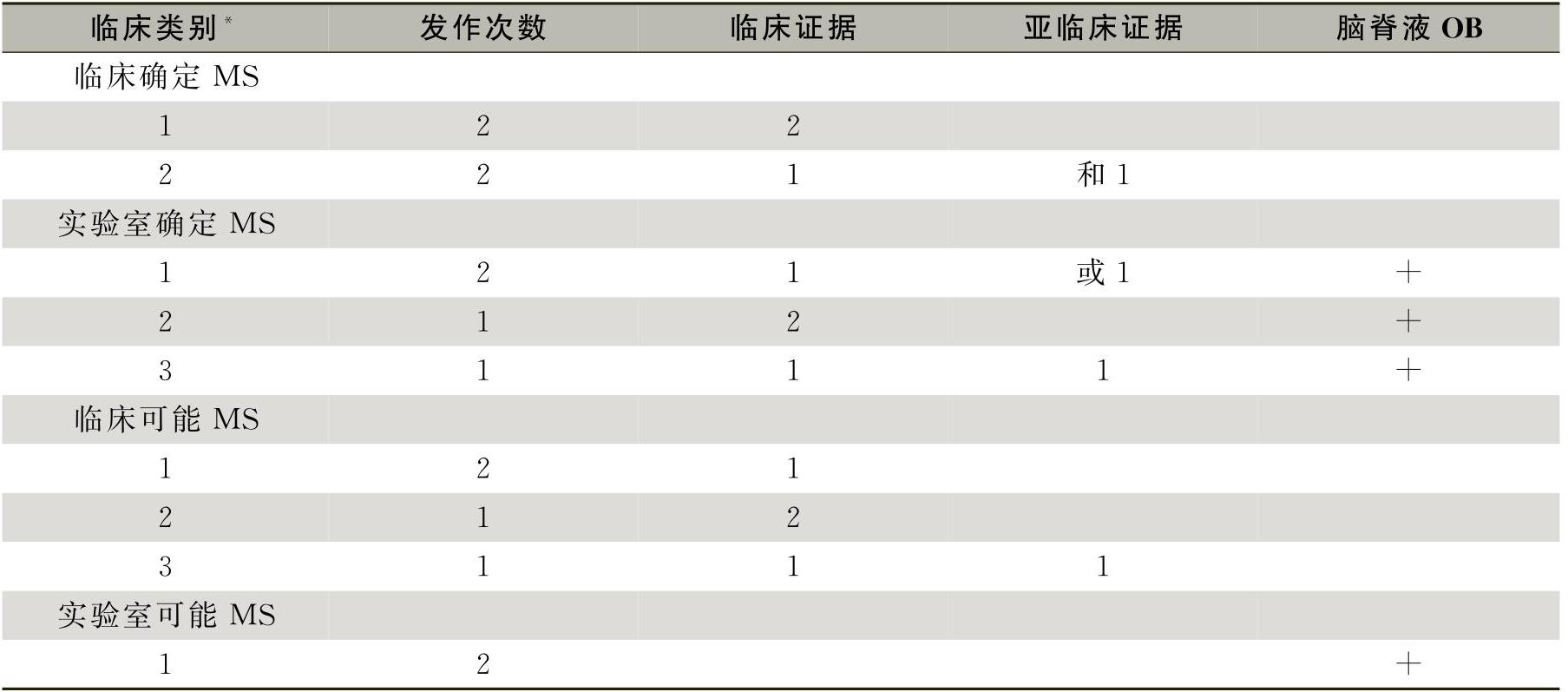
脑脓肿 桡骨茎突 情感性心-
肥胖病科
-
感染科
脑脓肿 桡骨茎突部狭窄性腱鞘炎 情感性心境障碍 附睾炎 大动脉炎 念珠菌病 霍乱 隐球菌病 白喉 细菌性痢疾 流行性出血热 流行性腮腺炎 气性坏疽 甲型病毒性肝炎 麻疹 狂犬病 回归热 败血症 伤寒 病毒性肝炎 乙型病毒性肝炎 H7N9 胆汁郁积性肝病 流行性甲型脑炎 大肠埃希杆菌性胃肠炎 小儿麻痹症 获得性免疫缺陷综合征 阿米巴病 慢性乙型肝炎 囊虫病 猪囊虫病 流行性乙型脑炎伴发的精神障碍 肠道病毒71型感染 口蹄疫 森林脑炎 混合性厌氧菌感染 肺外结核 球孢子菌病 天花
-
过敏反应科
-
呼吸内科
脑脓肿 桡骨茎突部狭窄性腱鞘炎 情感性心境障碍 附睾炎 大动脉炎 急性呼吸窘迫综合症 肺泡蛋白沉着症 小细胞肺癌 呼吸性细支气管炎间质肺病 肺部感染 肺脓肿 组织胞浆菌病 呼吸系统疾病 肺空洞 非典 尘螨过敏性哮喘 真菌过敏性哮喘 难治性哮喘 咳嗽变异性哮喘 尿毒症肺炎 肺损伤 肺栓塞 肺动脉高压 病毒性肺炎 急性支气管炎 急性扁桃体炎 哮喘性肺嗜酸粒细胞浸润症 肺不张 细菌性肺炎 支气管哮喘 哮喘 支气管结石 支气管扩张 慢性支气管炎 慢性肺心病 慢性阻塞性肺疾病 慢性阻塞性肺病 慢性咽炎 老年人肺心病 肺气肿 食物过敏性哮喘 肺纤维化 流行性感冒 间质性肺炎 间质性肺疾病 肺癌 阻塞性肺气肿 肺水肿 胸腔积液 气胸 肺念珠菌病 肺曲菌病 急性呼吸衰竭 呼吸衰竭 肺结节 睡眠呼吸暂停综合征 自发性气胸 葡萄球菌肺炎 哮喘持续状态 喉气管狭窄 支气管炎 肺炎
+更多
-
-
外科
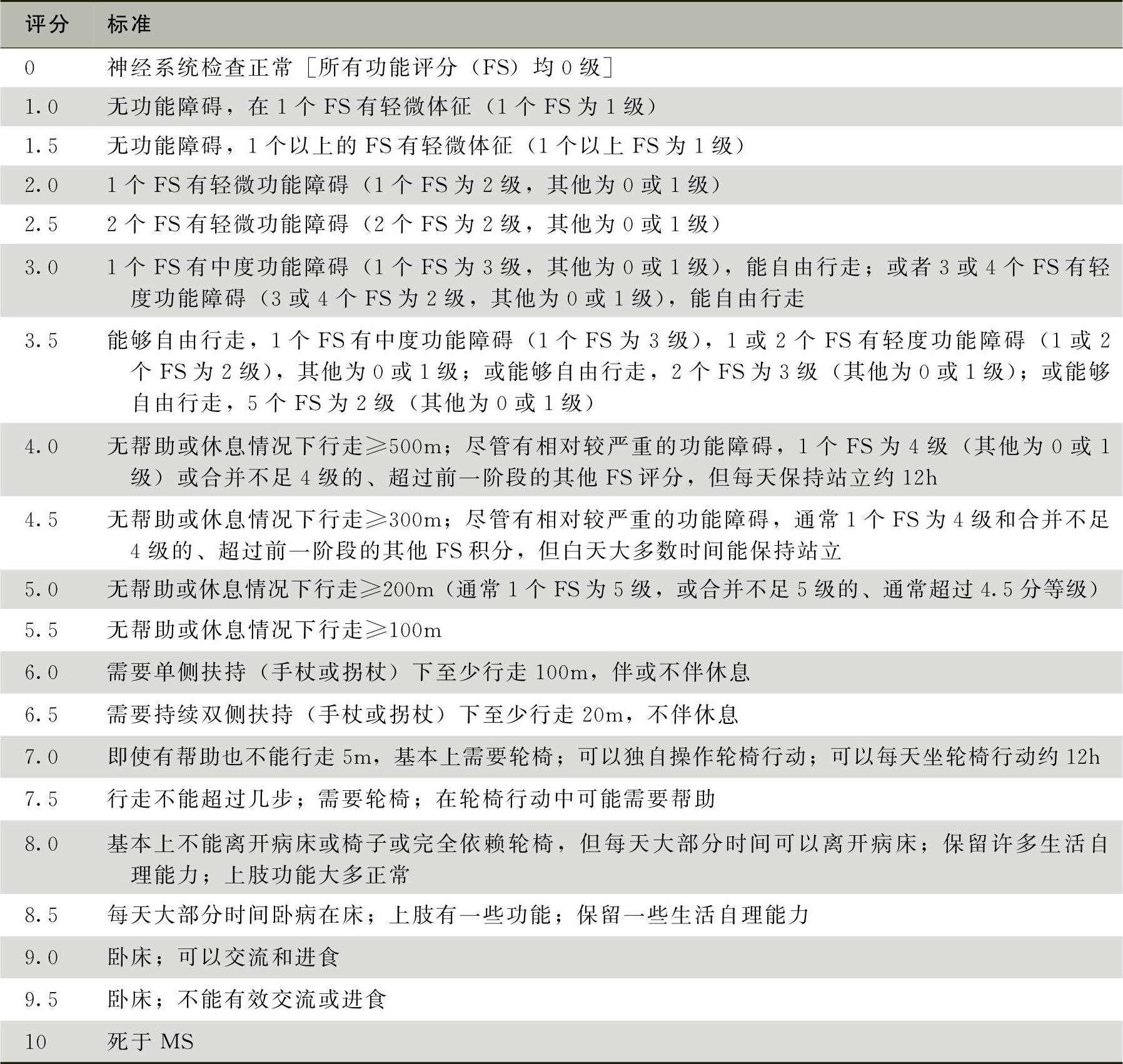
下尺桡关 肩周炎 脊柱侧凸-
肝胆外科
下尺桡关节脱位 肩周炎 脊柱侧凸 先天性髋关节脱位 透析性骨关节病 增生性骨关节病 颌骨骨折 胰腺炎 胆管结石 胆管狭窄 胆石病 毛细胆管炎 胆囊癌 肝肿瘤 胆总管结石 闭塞性胆管炎 胆囊管综合征 肝脏血管瘤 肝癌 原发性肝癌 转移性肝癌 胆囊良性肿瘤 肝脏肿瘤 胆道感染 胆管癌 胰腺癌 胆囊炎 先天性胆道闭锁 肝脏局灶性结节性增生 胆囊结石 肝囊肿 肝衰竭 肝纤维化 肝硬化 Mirizzi综合征 胰腺脓肿 胰腺囊肿 胰腺肿瘤 壶腹周围癌 胆囊息肉 重症肝炎 脾动脉瘤 内脏动脉瘤 小肠间质瘤术后肝转移
-
肛肠外科
下尺桡关节脱位 肩周炎 脊柱侧凸 先天性髋关节脱位 透析性骨关节病 增生性骨关节病 颌骨骨折 肛乳头瘤 肠系膜淋巴结炎 肠瘘 胃肠道肿瘤 直肠肿瘤 直肠溃疡 直肠癌 大肠血管瘤 结直肠癌 直肠息肉 肛裂 肛瘘 结肠恶性肿瘤 大肠癌 先天性肛门直肠畸形 先天性巨结肠 克罗恩病 小肠瘘 胃肠道间质瘤 痔疮 大肠梗阻 小肠肿瘤 大肠肿瘤 大肠平滑肌肉瘤 肛周脓肿 直肠脱垂 直肠阴道瘘 结核性腹膜炎 溃疡性结肠炎
-
泌尿外科
下尺桡关节脱位 肩周炎 脊柱侧凸 先天性髋关节脱位 透析性骨关节病 增生性骨关节病 颌骨骨折 前列腺炎 肾上腺肿瘤 生殖器畸形 男性不育症 支原体感染 肾盂输尿管连接部梗阻 遗尿 输尿管畸形 附睾炎 性功能障碍 隐睾症 腹膜后纤维化 尿道感染 肾恶性肿瘤 肾结石 膀胱恶性肿瘤 尿石症 阴茎恶性肿瘤 妊娠合并急性肾盂肾炎 腺性膀胱炎 间质性膀胱炎 肾结核 肾脏肿瘤 压力性尿失禁 泌尿系统肿瘤 肾母细胞瘤 急性肾盂肾炎 无精子症 膀胱结石 膀胱肿瘤 输尿管结石 尿结石 前列腺恶性肿瘤 肾盂癌 睾丸肿瘤 隐匿阴茎 先天性巨尿道症 膀胱炎 排尿功能障碍疾病 勃起功能障碍 两性畸形 鞘膜积液 肾积水 尿道下裂 肾囊肿 男性尿道癌 肾炎 肾下垂 神经源性膀胱 梗阻性肾病 膀胱过度活动症 嗜铬细胞瘤 多囊肾 早泄 前列腺增生 肾盂肾炎 包皮过长 肾动脉狭窄 肾损伤 精囊炎 老年人泌尿系结石 尿失禁 输尿管损伤 尿道狭窄 泌尿系统感染 尿路梗阻 输尿管肿瘤 精索静脉曲张 黄色肉芽肿性肾盂肾炎
-
普外科
下尺桡关节脱位 肩周炎 脊柱侧凸 先天性髋关节脱位 透析性骨关节病 增生性骨关节病 颌骨骨折 胰腺炎 胆囊管综合征 原发性肝癌 乳房导管内乳头状瘤 腹壁挫伤 食管胃底静脉曲张及其破裂出血 腹壁坏死性筋膜炎 腹壁血栓性静脉炎 白线疝 后腹膜肿瘤 腹外疝 肠扭转 慢性阑尾炎 大网膜扭转 胆管狭窄 十二指肠憩室 食管息肉 胃肠道狭窄 疝气 造口旁疝 半月线疝 胃肠道肿瘤 肠道肿瘤 直肠肿瘤 直肠癌伴肝转移 小肠间质瘤术后肝转移 小肠腺癌 小肠平滑肌肉瘤 结直肠癌 小肠原发性恶性淋巴瘤 腹膜后脓肿 粘连性肠梗阻 腹壁肿瘤 脾脓肿 急性肝功能衰竭 直肠腺癌 小肠腺瘤 阑尾炎 乳腺脓肿 腹壁硬纤维瘤 十二指肠损伤 肌上皮细胞腺瘤 上皮样肉瘤 股疝 腹壁纤维肉瘤 消化道异物 胃恶性肿瘤 胃癌 胃癌前病变 胃泌素瘤 胃间质瘤 膝关节滑膜炎 肝肺综合征 肝肾综合征 切口疝 腹壁切口疝 腹股沟疝 膝关节半月板损伤 脂肪瘤 淋巴水肿 神经内分泌肿瘤 嵌甲 胃溃疡性穿孔 腹膜炎 胃恶性淋巴瘤 乳腺癌 脾动脉瘤 脾囊肿 小肠毛细血管扩张 小肠破裂 甲状腺腺瘤 脐疝
+更多
-
-
妇产科
不孕症 围生期心 卵巢囊肿-
妇科
不孕症 围生期心肌病 卵巢囊肿 习惯性流产 多囊卵巢综合症 女性不育 绝经 痛经 胎停育 妇科肿瘤 盆腔炎 围绝经期综合症 宫颈HPV感染 子宫颈息肉 宫腔粘连 卵泡发育不良 异位妊娠(宫外孕) 妇科炎症 卵巢浆液性肿瘤 乳腺囊肿 外阴瘙痒症 围绝经期前后的外阴白色病变 蛲虫性阴道炎 妇科内分泌失调 月经过多 宫颈腺癌 外阴横纹肌肉瘤 卵巢肿瘤 异常子宫出血 流产 妊娠合并急性肾盂肾炎 子宫腺肌瘤 前庭大腺囊肿 前庭大腺炎 外阴基底细胞癌 子宫内膜癌 外阴癌 宫颈赘生物 宫颈炎 宫颈癌前病变 宫颈糜烂 先天性无阴道 环状外阴炎 宫颈癌 子宫内膜异位 直肠子宫内膜异位症 输卵管妊娠 外阴隆凸性皮肤纤维肉瘤 卵巢纤维瘤 功能性子宫出血 霉菌性外阴炎 妊娠期糖尿病 婴幼儿外阴阴道炎 间质性膀胱炎、局限性外阴炎和脱屑性阴道炎综合征 外阴硬化性苔藓 卵巢恶性中胚叶混合瘤 子宫内膜息肉 卵巢癌 卵巢残余综合征 妊娠高血压综合征 胎盘早期剥离 子宫憩室 输卵管堵塞 自然流产 盆底功能障碍性疾病 外阴早期浸润性鳞癌 外阴汗腺腺癌 畸胎瘤 先兆流产 子宫脱垂 阴道炎 外阴脂肪肉瘤 女性更年期综合征 月经失调 子宫肌瘤
+更多
-
-
中医科
经断复来 化脓性颌 感冒 -
药剂科
+更多
-
其它科室
+更多